|
全国免费电话:400-668-6834 -- 仅限中国地区 -- |
在线订购:QQ: 4006686834 电话订购:021-68591985 邮件订购:info@selleck.cn 我们也提供销售人员上门服务 |
技术支持电话:400-168-6834 我们将于一个工作日与您联系 |
产品描述
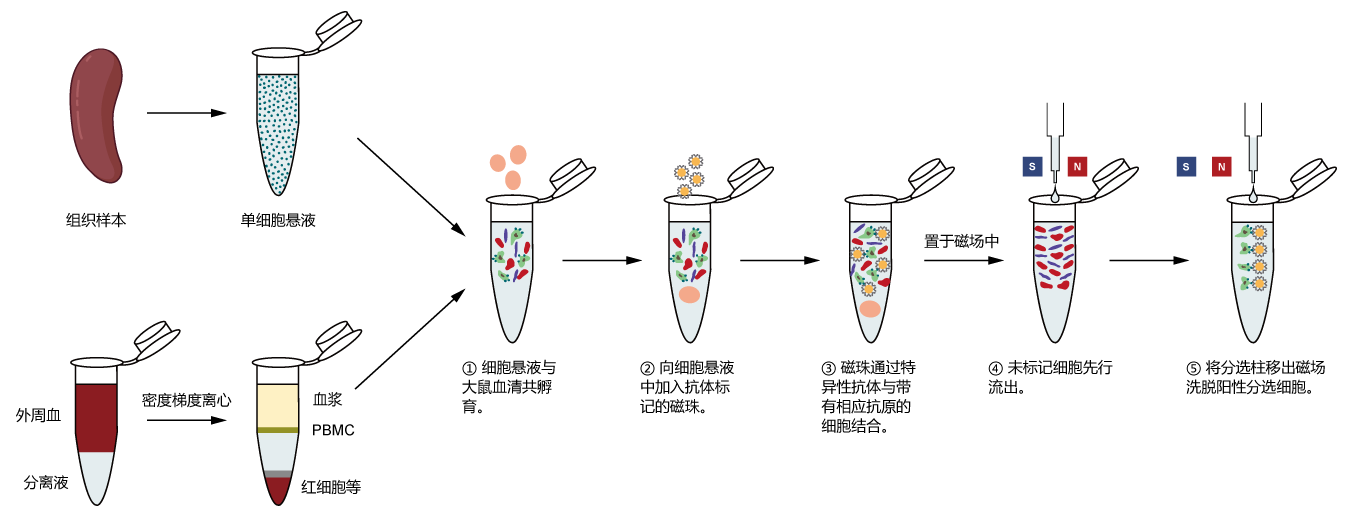
实验步骤
缓冲液配制: PBS缓冲液(pH 7.2)包括0.5%的BSA和2 mM EDTA,需预先通过0.22 μm滤膜过滤除菌。
1. 样本准备:
淋巴/非淋巴组织样本(以小鼠脾脏为例):
a. 在70 μm细胞筛网上研磨脾脏,以预冷的 PBS 冲洗细胞筛网,收集细胞悬液于50 ml 离心管中,500 g,离心5 min。
b. 离心完成后,弃上清,加入5 ml ACK 红细胞裂解液,室温裂解5 min,再加入20 ml PBS,500 g,离心5 min。
注意:红细胞裂解步骤可根据所用裂解液不同调整用量及时间。少量红细胞残留不会影响后续分选及细胞纯度。
c. 离心完成后,弃上清,将脾细胞重悬于PBS,细胞悬液用70 μm细胞筛网过滤后,计数。计数完成后,继续以500 g,离心5 min。
d. 离心完成后,弃上清,将细胞重悬于分选 buffer 中,调整细胞密度为1×108 cells/ml。
小鼠外周血样本:
a. 新鲜抗凝全血加入 PBS 或生理盐水按 1:1 比例稀释降低血液粘稠度,使用淋巴细胞分离液 Ficoll,通过密度梯度离心法分离得到 PBMC。
b. 向 PBMC 中加入 5-10 倍体积的分选 buffer,混匀后离心,300 g 离心10 min,弃上清。重复洗涤 2-3 次。
c. 用分选 buffer 重悬细胞,调整细胞密度为1×108 cells/ml。
2. 大鼠血清孵育:每107 细胞中加入 20 µL 正常大鼠血清,混匀后常温孵育10 min,每隔5 min 轻弹混匀。
注意:分选更多细胞时,按比例增加大鼠血清用量(如分选5×107细胞,需在500 µL 细胞悬液中加入100µL 大鼠血清)。
3. CD8a微珠标记:每107细胞中加入 10 µL CD8a微珠,混匀后 4 ℃孵育15 min,每隔5 min轻弹混匀,避免细胞聚集。
注意:分选更多细胞时,按比例增加CD8a微珠用量(如分选5×107细胞,需在500 μL细胞悬液中加入50 μL CD8a微珠)。
4. 洗涤细胞:孵育完成后,加入1 mL分选buffer(避免剧烈振荡或上下颠倒混匀)。300 g离心3 min,弃上清,加入1 mL分选buffer重悬细胞。
5. 磁珠分选:
将分选柱置于MACS分离器的磁场中,用缓冲液冲洗分选柱(MS柱: 500 μL;LS柱: 3 mL)。
将细胞悬液加入分选柱,收集未标记的流经细胞(可选),再用分选液清洗分选柱(MS柱: 2×1 mL;LS柱: 2×3 mL)。
6. 收集CD8a阳性细胞:移出分选柱,加入适量缓冲液,用柱塞快速冲洗,收集磁性标记的CD8a阳性细胞(MS柱: 2×1 mL;LS柱: 2×3 mL)。
注意:每次液体完全流尽后再进行下一步操作。
7.(可选)二次富集: 若需更高纯度,可重复步骤5-6,在第二个分选柱上再次富集CD8a阳性细胞。
实验全程保持低温(4℃),动作迅速以减少细胞损伤。
